
官方发文,剑指临床药物研发!这类「创新」将遭当头一棒
- 作者:罗春昊
- 来源:健康界
- 发布时间:2021-11-23 14:11
官方发文,剑指临床药物研发!这类「创新」将遭当头一棒
【概要描述】不以临床为导向的创新,或将被视为「伪创新」。
- 作者:罗春昊
- 来源:健康界
- 发布时间:2021-11-23 14:11
不以临床为导向的创新,或将被视为「伪创新」。
11月19日,国家药监局药审中心发布关于《以临床价值为导向的抗肿瘤药物临床研发指导原则》(下称《指导原则》)明确指出,抗肿瘤药物的研发,从研发立题、到开展临床试验设计,都应从患者需求出发,而不仅仅是患者反馈的收集和量表的开发。
这一文件的发布,进一步明确了创新的「定义」。这意味着,那些临床价值不高的新药,将会被退回或增加审批难度,相关企业投资或将「打水漂」。
不过,《指导原则》无疑将提振真正具备创新精神企业的研发热情。那些拥有资金优势的创新药企以及拥有丰富临床试验经验的头部CRO(医药研发外包企业)企业或将从中受益。
靴子落地
实际上,《指导原则》酝酿已久。自2015年起,以临床价值为导向的药物创新研发就已经成为国家药监局药审中心审批改革的一项重要内容。
2021年1月,由国家药监局药审中心化学药临床一部牵头制定《指导原则》,并于7月发布征求意见稿。经过5个月的论证及完善,《指导原则》最终正式发布。
至此,「靴子」终于落地。长期以来,药品上市的根本目的是解决患者需求,进行以临床价值为导向的药物研发已成为普遍共识。
健康界梳理发现,不管是《药品管理法》还是《药品注册管理办法》,均对此进行了强调。

图|新版《药品管理办法》
为何要以临床价值为导向?
2015年国务院在《关于改革药品医疗器械审评审批制度的意见》中就提出,要鼓励以临床价值为导向的药物创新。在此后的六年间,我国创新药审批数量大幅提升。
但在审批「量」激增的背景下,「质」却稍显滞后。根据《中国新药注册临床试验现状年度报告》(2020年),中国新药临床试验的数量和药物品种的数量相较以往都大幅增加,但药物靶点和适应症领域分布较为集中,也就是说我国药物临床试验迅速发展的同时,存在临床试验同质化的问题。
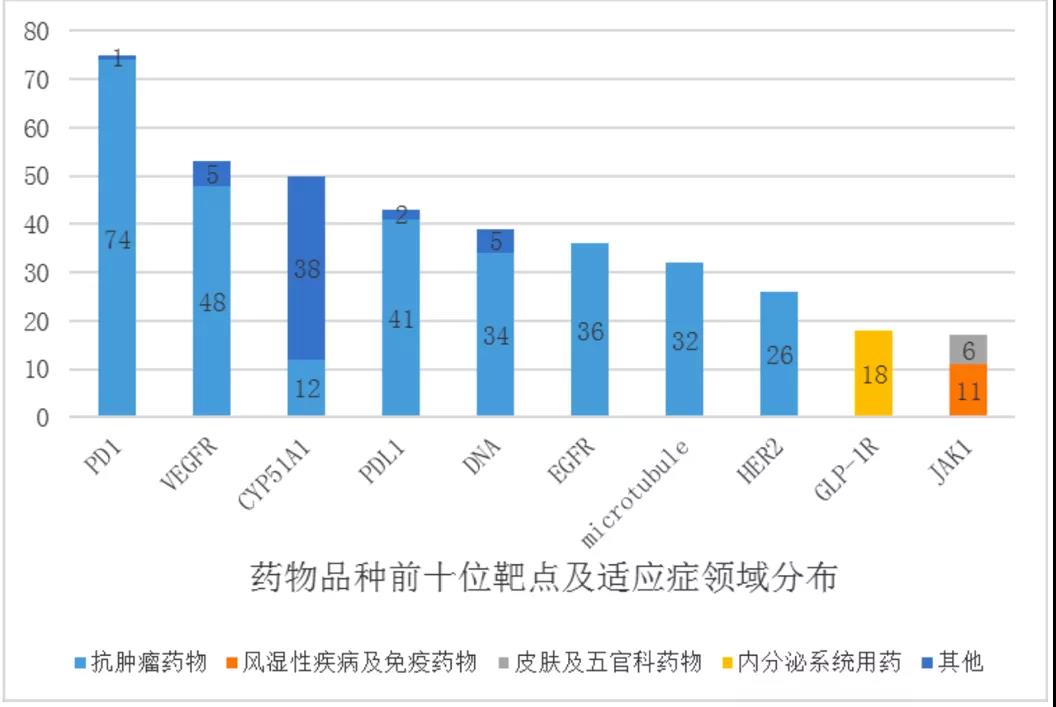
数据显示,从2020年临床试验数量前10位靶点分布情况来看,主要集中在PD-1、 VEGFR 等,其中 PD-1、VEGFR、PD-L1 等靶点的品种开展的临床试验均超过 60 多项。其中PD-1 靶点的临床试验的数量更是将近 100 项。
有专家认为,像PD-1、VEGFR、PD-L1等这类严重同质化的产品,是临床研究资源的巨大浪费,同时,相同靶点的市场环境也异常激烈。面对靶点同质化,究其原因,「一方面是药企获取信息渠道的有限性、对靶点的了解有限,跟随已有的靶点,成功率更高。」
「另外一方面,国内市场上可供选择的模型动物种类有限,冷门靶点关注人少,没有利益驱使,无利可图的情况下,企业也不愿意开发模型动物,没有模型动物的靶点关注人数更少,从而造成同质化越来越严重。」百奥赛图基因生物公司沈月雷董事长在接受媒体采访时表示。除靶点同质化严重外,老人、儿童领域的药物创新研发仍存「洼地」。
今年9月,国家药品监督管理局药品评审中心(下称:药审中心)副主任周思源在第六届中国医药创新与投资大会发表演讲时提供了一组数据。2018-2020年中国国家药品监督管理局(NMPA)批准的39个创新药中,First-in-class新药2个(5%);与此同时,FDA批准的160个创新药中,First-in-class新药达到60个(38%)。
从数据上看,我国First-in-clas的新药数量要远远低于FDA。特别是批准新药的结构上,除了抗肿瘤、抗病毒和抗感染以及镇痛药的比例与FDA基本相同以外。在人群的划分,老人、儿童药物的创新研发仍然存在一定差距。
周思源坦言,实现药物创新的量质齐升,需要企业、药品监督管理部门的共同努力。药审中心的角色也因此要从仿制药的审评向药物创新审评转变。企业要密切关注各领域的临床需求,如罕见病、儿童用药等,加强基础研究和机制研究,改善药物的安全性和治疗体验;同时转变思维,建立基于临床价值的药物发现、探索和试验研发路径,通过高标准、高质量、高效率的临研发为临床价值的评估提供全面、科学的证据。
「伪创新」药企获批或更难 利好真创新、CRO、CXO企业
几家欢喜,几家愁。此次《指导原则》的出台,激起市场极大反响,在一定程度上「挤掉」了创新药的估值泡沫。
健康界梳理发现,《指导原则》共五大部分,除了背景介绍、总结与参考文献的展示外,着重明确了药企要在「确定研发立题」、「临床试验设计」上,要体现患者需求。其中,从「确立研发立题」来看,不仅需要药企倾听患者声音,也需要加强机制研究、提高精准化治疗、关注患者治疗需求的变化、从而不断改善药物的安全性和治疗体验与便利性。
从「临床试验设计」来看,《指导原则》指出抗肿瘤药物在选择阳性药作为参照时,应关注该阳性药是否反映和代表了目标适应症患者最佳用药情况,而不应该为提高临床试验成功率和试验的成功率,选择安全性和/或有效性不确定,或已被更优的药物所替代的治疗手段。
当计划选择安慰剂或BSC(最佳支持治疗)作为对照药时,则应确保适应症在临床中确无标准治疗;如果有BSC时,应优选BSC作为对照,而非安慰剂。

此外,《指导原则》中提出,「如果有BSC(最佳支持治疗)时,应优选BSC作为对照。」这无疑会增加药企临床试验成本,对新药研发中的临床试验设计与患者招募也提出更高要求。对于《指导原则》的正式出台,有证券研究机构表示,这使得药企创新能力更强,致力于Me better和First in class药研发的药企将受益,同时也无形中加大了药企新药研发难度;另一方面,头部CXO公司凭借技术平台与申报经验优势,有望在此条件下,增加订单数量。也就是说,那些拥有资金优势的创新药企、拥有丰富临床试验设计经验及充足临床资源的头部CRO将获益。
在中国,自2000年至2004年期间,随着药明康德、睿智化学、泰格医药等本土企业相继成立后,CRO才逐渐兴起。这个比欧美起步晚了十余年的行业,如今已经发展为「黄金赛道」。与今年第三季度制药公司艰难度日相比。《指导原则》的出台,或将使CRO行业继续奏乐、继续舞。
责任编辑:亦欣
免责声明:著作权归原作者所有,在此向原作者表示感谢。除非无法确认,本网都会注明作者及来源。如有版权异义请及时告知。




















