
美国FDA发文抨击PD-1赛道扎堆、内卷、Me-too现象!
- 作者:
- 来源:药时代
- 发布时间:2021-12-31 14:29
美国FDA发文抨击PD-1赛道扎堆、内卷、Me-too现象!
【概要描述】截止当下,已上市的PD-1/PD-L1药物的适应症中的45%是通过加速审批(Accelerated Approval)这一途径获批的,通常是只做了单臂试验,之后的验证性随机临床试验显示出不一致的结果。
- 作者:
- 来源:药时代
- 发布时间:2021-12-31 14:29

Rick Pazdur医学博士(图片来源:AACR)
尽管肿瘤免疫疗法的发展提高了常见癌症患者的总体生存率,带来了重要的治疗进展,但全球检查点抑制剂(Checkpoint Inhibitor)类药物的快速扩张在很大程度上缺乏协调,造成了很大的浪费。

01
遏制过度开发
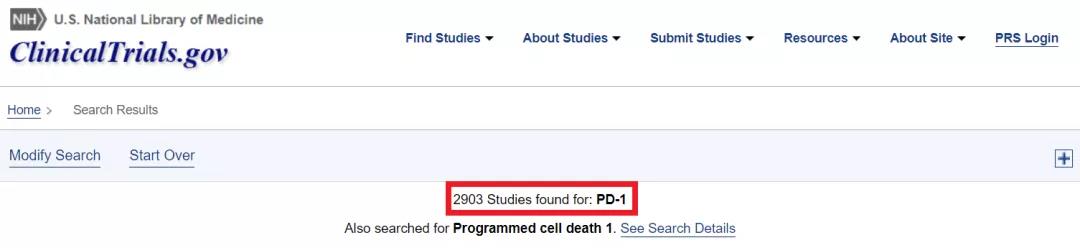
图片来源:ClinicalTrials.gov
默沙东的Keytruda(K药)是关注度最高的PD-1/PD-L1新药之一。因为Keytruda未能在验证性临床实验中产生预期的治疗效果,今年4月30日,FDA的肿瘤药物顾问委员会投票反对将Keytruda用于胃癌的三线治疗。2个月后,默沙东主动撤回该加速批准。
02
更严格的标准化
这些开发计划通常不分开考虑组合成分的影响,这是有问题的,因为新抗体的安全性和有效性尚未确定,而是基于已被批准的检查点抑制剂进行推断,这在法规上是行不通的。而使用多种体外诊断测试来选择特别有可能对此类药物产生反应的患者,进一步显示了开发计划之间缺乏协调。
FDA已经批准了三种不同的检测PD-L1表达的伴随诊断,具有各种临界值的肿瘤突变负荷(TMB)诊断方法也在开发中。TMB诊断方法衡量的指标是癌细胞内基因突变数量,可指明细胞是否更有可能被识别为异常并受到身体免疫系统的攻击。但同样的,这方面也缺乏协调。
对于这些不同的测试方法是否识别相同的患者群体,目前还没有达成共识,而且大多数检查点抑制剂的适应症已在未根据生物标志物状态而选择的人群中获得批准。下一步研发的可能结果是,确定复杂的遗传特征是免疫治疗获益或缺乏获益的最佳预测指标,而这将需要对产品和适应症进行更严格的标准化。
03
强调头对头比较
检查点抑制剂正在早期疾病中进行测试,包括在辅助治疗和新辅助治疗临床试验中,以及在可能最终为许多患者提供治愈的新型组合疗法中进行试验。两位专家指出,这种检查点抑制剂的“无节制的快速增长” 导致了药物开发的“狂野西部”,结果就是商业化申办方、临床试验和冗余的开发计划蜂拥而至。
04
参考资料:
-
Uncoordinated and redundant: FDA's Pazdur slams checkpoint inhibitor developers for creating a 'Wild West'
-
The Wild West of Checkpoint Inhibitor Development (https://www.nejm.org/doi/full/10.1056/NEJMp2116863)
-
UPDATED: Merck, Roche and Bristol Myers nab 4 of 6 positive ODAC votes for ‘dangling’ accelerated approvals
责任编辑:亦欣
免责声明:本网注重分享,并不意味着赞同本文观点或证实内容的真实性,请仅做参考。著作权归原作者所有,在此向原作者表示感谢。除非无法确认,本网都会注明作者及来源。如有版权异义请及时告知。




















